
PET分解酵素の立体構造解明で、プラスチックゴミ問題に光
使い捨ての「ペットボトル」の材料であるポリエチレンテレフタレート(PET)は、ほかのプラスチックと同様に汎用性が非常に高い反面、何百年も分解されずに環境に蓄積され、特に海洋環境において動植物に深刻なリスクをもたらすことで知られている。このほど、英国ポーツマス大学と米国エネルギー省の国立再生可能エネルギー研究所の共同チームが、このPETを分解する酵素の立体構造を解明した。酵素自体は2016年に日本で発見されたもの。今回の研究の過程では偶然、プラスチック分解力がさらに優れた酵素も発見されており、プラスチックでできた何百万トンものゴミをリサイクルできる可能性が広がった。米国立科学アカデミー紀要(PNAS)で17日に発表された。
日本で発見されたPET分解酵素
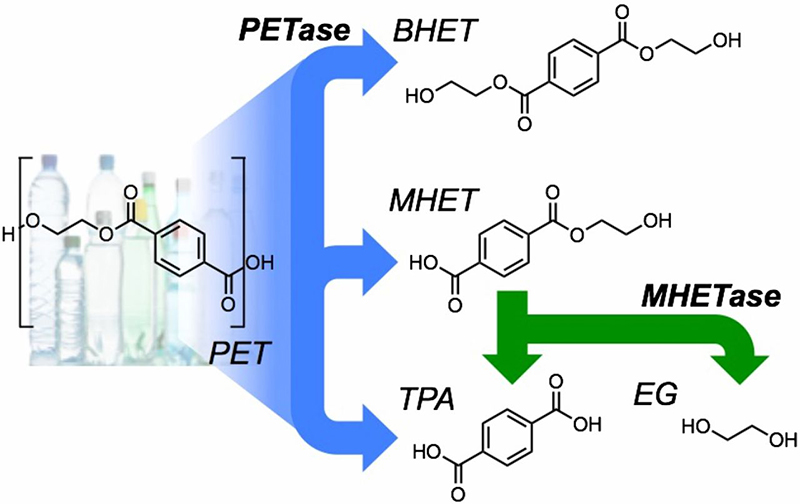
今回、立体構造が解明されたPETを分解する酵素は、2016年に、当時慶應義塾大学理工学部の助教だった吉田昭介氏(現:奈良先端科学技術大学院大学バイオサイエンス領域特任准教授)らによって発見された。同研究グループは、大阪府堺市のリサイクル工場で採取したPETの屑を含む試料からPETを分解できる細菌を発見、堺市にちなんで「イデオネラ・サカイエンシス201-F6株」と命名した。さらにこの細菌のゲノム情報をもとにPETを分解する酵素を探索、PET分解酵素(PETase)ともう1つの酵素によってPETを効率的に分解できることを明らかにした。
酵素の変異体にさらに優れた能力
1940年代に特許が認可されたPETは、それまで自然界に存在していなかった合成化合物。今回、米英の研究チームはこのPETaseが自然界でどのように進化したのか、更に能力を改良できるのかを検証、酵素の立体構造を解析した。さらに、米国の南フロリダ大学とブラジルのカンピナス大学のコンピュータモデリング科学者の助けを借りることで、PETaseがクチン分解酵素(クチンは植物の表面を保護するクチクラの主成分)と非常によく似た構造をしているが、クチンのような天然高分子だけでなく人工高分子であるプラスチックにも反応する活性部位を持つことを発見した。そこで、PETaseの活性部位を突然変異させてみたところ、変異体はもとの活性部位よりもPETを分解する能力が優れていたことが明らかになった。またこの変異体は、ガラス製のビール瓶の代替品として注目を集めるポリエチレンフラノエート(PEF:100%バイオ由来の材料で合成でき、PETよりも気体を通しにくい特徴を持つ)も分解することができた。
工業化に向けてさらなる改良に期待
英ポーツマス大学のマクギーハン教授は、「予期しなかった発見。この酵素にさらなる改良の余地があることを示している」と語った。また、この論文の主著者であるポーツマス大学の大学院生、ハリー・オースティンさんは、「この研究はほんの序章に過ぎません。この分野は、私たちの惑星が直面している最大の問題のひとつです。それに取り組む国際チームの一員になることができうれしいです」と述べた。同チームは現在、酵素を工業的に使用するために、ほんのわずかの時間でプラスチックを分解できるように、酵素をさらに改良することに取り組んでいる。
画像提供:PNAS(冒頭の写真はwww.upixphotography.com提供、ポーツマス大学マクギーハン教授)

